

 Conforme vimos na aula Por
que História e Epistemologia da Ciência,
a
Teoria do Flogisto
(ou do Flogístico) foi proposta pelo químico e
médico alemão Stahl, entre 1703 e 1731, para
explicar os processos de combustão
e calcinação, como
desenvolvimento do conceito
de terra pinguis de Becher.
Conforme vimos na aula Por
que História e Epistemologia da Ciência,
a
Teoria do Flogisto
(ou do Flogístico) foi proposta pelo químico e
médico alemão Stahl, entre 1703 e 1731, para
explicar os processos de combustão
e calcinação, como
desenvolvimento do conceito
de terra pinguis de Becher.Segundo essa teoria, as substâncias combustíveis possuiriam dentro delas um 'princípio', o flogistico, que, durante os processos de combustão ou calcinação, seria libertado para o meio ambiente. Quando se acabasse o flogístico da substância, ela não poderia mais queimar e se tornaria incombustível. O flogístico libertado na atmosfera seria gradualmente absorvido pelas plantas.

O flogisto era considerado como o 'elemento' fogo combinado e tornado num dos princípios constitutivos dos corpos combustíveis; sempre que o flogisto se combinasse com uma substância não inflamável, daria lugar a um novo composto, capaz de se inflamar.
O flogístico não teria a mesma afinidade para todas as substâncias; combinar-se-ia facilmente com os sólidos mas teria dificuldade em se combinar com os materiais fluidos leves e voláteis.
 Na
verdade, Lavoisier não descobriu o
oxigênio,
pois esse gás já tinha sido identificado
independentemente por Scheele em 1772 e Priestley em 1774. Lavoisier ficou
sabendo desse gás através de uma visita que
Priestley fez a ele e
decidiu reproduzir suas experiências.
Na
verdade, Lavoisier não descobriu o
oxigênio,
pois esse gás já tinha sido identificado
independentemente por Scheele em 1772 e Priestley em 1774. Lavoisier ficou
sabendo desse gás através de uma visita que
Priestley fez a ele e
decidiu reproduzir suas experiências. Philon de Bizâncio (280
a.C. – 220
a.C.) já havia observado que uma vela queimando sob uma
campânula com
água faria o nível d'água subir, mas
interpretava isso como o
'elemento' ar se transformando no 'elemento' fogo que, sendo mais
rarefeito, escaparia pelos poros do vidro.
Philon de Bizâncio (280
a.C. – 220
a.C.) já havia observado que uma vela queimando sob uma
campânula com
água faria o nível d'água subir, mas
interpretava isso como o
'elemento' ar se transformando no 'elemento' fogo que, sendo mais
rarefeito, escaparia pelos poros do vidro. Leonardo
da Vinci afirmava que uma
parte do ar era 'consumida' duarante a
combustão e a
respiração.
Leonardo
da Vinci afirmava que uma
parte do ar era 'consumida' duarante a
combustão e a
respiração. Boyle
já havia demonstrado que o ar era necessário para
a combustão.
Boyle
já havia demonstrado que o ar era necessário para
a combustão.Mayow havia descoberto que somente uma parte do ar era necessária para a combustão, a que ele chamou de 'espírito nitro-aéreo' pois ele identificou-o como uma das partes da porção ácida do nitro (nitrato de potássio), que, efetivamente, liberta oxigênio quando aquecido, sendo, por isso, usado na pólvora.
 van Helmont
havia descoberto no século XVII que a fumaça da
combustão era diferente
do vapor d'água e do ar, introduzindo, então, a
noção de gás,
termo cuja etimologia vem de 'caos' que, na
Alquimia, designa algo como 'água altamente
rarefeita'
(PAGEL, 1982, p. 60). van Helmont denominou esse gás, obtido
da queima
do carvão, como 'ar selvagem'.
van Helmont
havia descoberto no século XVII que a fumaça da
combustão era diferente
do vapor d'água e do ar, introduzindo, então, a
noção de gás,
termo cuja etimologia vem de 'caos' que, na
Alquimia, designa algo como 'água altamente
rarefeita'
(PAGEL, 1982, p. 60). van Helmont denominou esse gás, obtido
da queima
do carvão, como 'ar selvagem'. Por
outro lado, Black
havia descoberto que calcários (carbonato de
cálcio), quando aquecidos,
libertavam um gás que ele chamou de 'ar fixo',
que
não mantinha a vida animal e que, se
borbulhado
através de 'água
de cal' (solução de óxido de
cálcio), precipitaria novamente
calcário.
Por
outro lado, Black
havia descoberto que calcários (carbonato de
cálcio), quando aquecidos,
libertavam um gás que ele chamou de 'ar fixo',
que
não mantinha a vida animal e que, se
borbulhado
através de 'água
de cal' (solução de óxido de
cálcio), precipitaria novamente
calcário.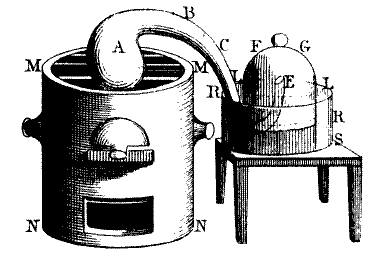
Numa experiência famosa, que Lomonossov já havia realizado 14 anos antes, sem reconhecimento na Europa, todavia, Lavoisier
Lavoisier demonstrou, também, o papel do oxigênio na oxidação dos metais (ferrugem), bem como, trabalhando com Laplace, na respiração animal e vegetal, desprovando a Teoria do Flogístico.

 Por outro lado, Cavendish,
havia explodido uma mistura de ar inflamável,
hoje
denominado hidrogênio (H), e o ar deflogisticado,
hoje conhecido como oxigênio (O),
percebeu que o
"orvalho" formado era água pura. Mas,
como era
partidário do flogístico
de Stahl e crente na concepção grega dos quatro
elementos,
Cavendish imaginou que
tais 'ares' eram versões do elemento água
sem flogístico
e com flogístico, respectivamente.
Por outro lado, Cavendish,
havia explodido uma mistura de ar inflamável,
hoje
denominado hidrogênio (H), e o ar deflogisticado,
hoje conhecido como oxigênio (O),
percebeu que o
"orvalho" formado era água pura. Mas,
como era
partidário do flogístico
de Stahl e crente na concepção grega dos quatro
elementos,
Cavendish imaginou que
tais 'ares' eram versões do elemento água
sem flogístico
e com flogístico, respectivamente.Lavoisier, ao contrário, demonstrou que a água não era um elemento, mas, sim, composta pelo "ar inflamável" (H) de Cavendish, a que Lavoisier chamou de hidrogênio, significando "formador de água", e o ar deflogisticado (O).
Desta forma, Lavoiser, estudando a combustão e a respiração,
Com isso, Lavoisier deflagrou uma verdadeira Revolução Química.
Apesar do trabalho de Lavoisier, a Teoria do Flogístico era defendida por muitos cientistas da época pois 'explicava' bem uma série de fenômenos:
| Flogístico | Oxigênio | |
| combustíveis | possuem muito flogístico | combinam bem com oxigênio |
| combustão | consumo de flogístico | combinação com oxigênio |
| fim da combustão num espaço fechado | saturação de folgístico | esgotamento do oxigênio |
| calcinação dos metais | libertam o flogístico, restando cinzas | combinam com oxigênio, produzindo óxidos (cinzas) |
| reconversão da cinza a metal com carvão | reincorporação do flogístico do carvão às cinzas, recuperando o metal | combinação do oxigênio do óxido com o carvão, produzindo gás carbônico e recuperando o metal |
| produção de cal virgem a partir do calcáreo | incorporação de flogístico ao calcáreo, produzindo a cal | libertação do gás carbônico a partir do carbonato (calcáreo), restando o óxido (cal virgem) |
| variação de massa | massa negativa do flogístico reduz a massa inicial do combustível | massa final aumentada pela combinação com oxigênio |
| oxigênio | ar deflogisticado, pode absorver flogístico do combustível e alimentar a combustão | oxigênio, pode combinar-se com o combustível e alimentar a combustão |
| formação da água | combinação de 'ar inflamável' (água com flogístico) (H) e 'ar deflogisticado' (água sem flogístico) (O); o flogístico das duas partes se anulava, restando água | combinação de hidrogênio e oxigênio |
| metabolismo animal | absorvem flogístico dos alimentos e o liberam para o ar | absorvem oxigênio do ar e utilizam na oxidação do carbono dos alimentos, libertando gás carbônico para o ar |
| fotossíntese das plantas | absorvem flogístico do ar, 'deflogisticando-o' | absorvem gás carbônico do ar e libertam oxigênio |
| circulação | sangue venoso descarrega flogístico nos pulmões, tornando-se arterial; em contato com o 'ar flogisticado' no corpo, absorve flogístico, tornando-se venoso | sangue venoso absorve oxigênio nos pulmões, tornando-se arterial; em contato com as células, absorve o gás carbônico, tornando-se venoso |
Como se vê, há que reconhecer que a Teoria do Flogístico, funcionando como "um exato filme em negativo do mundo real" (GOTTSCHALL, p. 231), tinha um grande poder explanatório, o que muito contribuiu para sua sobrevivência.
No entanto, como vimos na aula Por que História e Epistemologia da Ciência?, os livros texto, em geral, apresentam a História da Ciência como uma marcha triunfante de sucesso em sucesso, suprimindo as [importantes] contradições que marcaram o seu desenvolvimento (ROBILOTTA, 1988), obliterando teorias que foram científicas em certa época e foram, posteriormente, superadas.
Demonstrado que a Teoria do flogístico era inconsistente com seus resultados experimentais, conforme publicou em seu Réflexions sur le phlogistique, de 1783, Lavoisier propos a Teoria do calórico, baseada na existência de um 'fluido sutil', chamado calórico que fluiria de um corpo mais quente para outro menos quente, tendo, como vimos na aula Lavoisier e a Revolução Química, desenvolvido um calorímetro de gelo e introduzido o termo ‘caloria’, unidade de medida do calórico.
Tal como a Teoria do flogístico, analisada acima, a Teoria do calórico também tinha grande poder explanatório para uma série de fenômenos, tais como
Mais ainda, baseado nela, Laplace introduziu uma correção ao cálculo de Newton para a previsão teórica da velocidade do som nos gases que forneceu um valor que se manteve por um século!
Com isso tudo, manteve-se por muitos anos, até que Rumford e Joule a substituíram, como veremos na aula A crise da Física no inicio do século XX.
Boyle, em seu The Sceptical Chymist, havia introduzido a noção de elemento químico, como sendo
"certos corpos primitivos e simples, perfeitamente puros de qualquer mistura, que não são constituídos por nenhum outro corpo, ou uns pelos outros, que são os ingredientes a partir dos quais todos os corpos que chamamos misturas perfeitas são compostos de modo imediato, e nos quais estes últimos podem ser finalmente resolvidos." (BENSAUDE-VINCENT; STENGERS, 1992, p. 53).
Lavoisier, desenvolve a definição de Boyle, definindo elementos ou 'princípios dos corpos' como
"o último termo ao qual chega a análise, todas as substâncias que não podemos decompor por meio algum" (BENSAUDE-VINCENT; STENGERS, 1992, p. 53)
É interessante que ele faz a ressalva de que
"não que possamos assegurar que estes corpos, que nós consideramos como simples, não sejam eles mesmos compostos de dois ou mesmo de um maior número de princípios, mas como estes princípios jamais se separam, ou antes, como não temos nenhum meio de os separar, eles comportam- se para nós como os corpos simples, e não devemos supô- los compostos senão no momento em que a experiência e a observação nos tenham fornecido a prova" (BENSAUDE-VINCENT; STENGERS, 1992, p. 53-54).
Baseado nessa nova definição de elemento, Lavoisier e seus colaboradores, Louis Bernard Guyton de Morveau, Claude Louis Berthollet e Antoine François de Fourcroy, abandonando os poéticos nomes alquímicos, introduziram uma nova nomenclatura para as substâncias químicas de nomes sistematizados que indicavam a composição da substância (OKI, 2002).
Com isso, a Tabela de Substâncias Simples apresentada em seu Traité Élémentaire de Chimie (Tratado Elementar de Química), de 1789, lista 33 elementos, incluindo não só 'luz' e 'calórico', como também cal, magnésia, barita, alumina e sílica, hoje sabidamento óxidos, já que na época ainda não se conseguia decompor essas substâncias.

Lavoisier foi membro da Ferme Général, um sistema terceirizado de recolha de impostos utilizado na altura na França, a quem pertencia, também, Jacques Paulze, pai de Marie-Anne. O sistema era baseado num valor previamente acordado de recolha; tudo o que ultrapassasse esse valor, seria de pertença do contratado. Com isso, Lavoisier obteve tempo e recursos para suas pesquisas. Muitos membros da Ferme Général enriqueceram. Alguns tornaram-se patronos das artes e das ciências ou de benfeitorias públicas, outros tornaram-se ambiciosos e cruéis, explorando o povo. Por isso, a Ferme Général tornou-se um símbolo para tudo de ruim do Antigo Regime e presa a abater pelos revolucionários.
Numa ocasião, Lavoisier rejeitou como não científico um trabalho de Marat, especialmente por ele contrariar o 'divino' Newton. Marat, médico, filósofo e cientista, ficou mais conhecido, no entanto, como jornalista radical e um dos líderes políticos da Revolução Francesa. Suas concepções sobre a natureza da luz e da cor aproximavam-se mais das de Goethe, que não aceitava a idéia newtoniana de que a luz branca é composta por uma mistura de todas as cores. Com a recusa de Lavoisier, Marat teve negada sua candidatura à Académie des Sciences. Profundamente desgostoso, incitou o povo contra Lavoisier, acusando-o até de vender tabaco falsificado.
Lavoisier foi guilhotinado, juntamente com vários coletas da Ferme Général, acusado de 'inimigo do povo', após uma farsa de julgamento, durante o qual Marie-Anne tentou conseguir apoios dos amigos cientistas, inutilmente, no entanto. Durante sua tentativa de defesa, ouviu a reprimenda "A República não precisa de cientistas ou químicos."

É célebre a frase de Lagrange: "Não bastará um século para produzir uma cabeça igual à que se fez cair num segundo".
Em sua homenagem, o asteróide 6826 foi denominado 'Lavoisier'.
Após sua morte, Marie-Anne casa-se, em 1804, com Benjamin Thompson, mais conhecido na Física como Conde de Rumford, precursor da Termodinâmica, como veremos na aula A crise da Física no inicio do século XX.
Veja também este vídeo
Veja também esta página:
PAGEL, Walter. Joan Baptista Van Helmont: Reformer of Science and Medicine. Cambridge University Press, 1982.
Voltar à Parte Anterior
Voltar a Minhas Aulas.
Voltar ao começo desta página
Voltar à página principal de Física Interessante